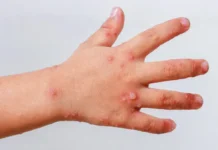
Los datos apoyan que los beneficios conocidos y potenciales de la vacuna superan sus riesgos conocidos y potenciales en personas de 18 años y mayores, y que esta vacuna puede ser eficaz para prevenir el COVID-19
13 de julio de 2022.- Hoy, la Administración de Alimentos y Medicamentos de los EE.UU. (FDA, por sus siglas en inglés) emitió una autorización de uso de emergencia (EUA, por sus siglas en inglés) para la vacuna contra el COVID-19 de Novavax con adyuvante para la prevención de COVID-19 causado por el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2) en personas de 18 años de edad y mayores.
«La autorización de una vacuna adicional contra el COVID-19 amplía las opciones de vacunas disponibles para la prevención del COVID-19, incluyendo los resultados más graves que pueden ocurrir, como la hospitalización y la muerte», dijo el comisionado de la FDA, el Dr. Robert M. Califf.
La autorización de hoy ofrece a los adultos en los Estados Unidos que aún no han recibido una vacuna contra el COVID-19 otra opción que cumple con los rigurosos estándares de la FDA para la seguridad, la eficacia y la calidad de fabricación necesarias para apoyar la autorización de uso de emergencia.
Las vacunas contra el COVID-19 siguen siendo la mejor medida preventiva contra la enfermedad grave causada por el COVID-19 y exhorto a cualquier persona que sea elegible para recibir la vacuna contra el COVID-19, pero que aún no la haya recibido, a que considere hacerlo».
La FDA ha determinado que la vacuna contra el COVID-19 de Novavax con adyuvante ha cumplido los criterios legales para la emisión de una EUA.
Los datos apoyan que los beneficios conocidos y potenciales de la vacuna superan sus riesgos conocidos y potenciales en personas de 18 años y mayores, y que esta vacuna puede ser eficaz para prevenir el COVID-19.
Al tomar esta determinación, la FDA puede garantizar al público y a la comunidad médica que se ha realizado un análisis y una evaluación exhaustiva de los datos de seguridad y eficacia disponibles y de la información de fabricación.
La vacuna contra el COVID-19 de Novavax con adyuvante se administra como un esquema primario de dos dosis, con un intervalo de tres semanas.
La vacuna contiene la proteína de pico del SARS-CoV-2 y el adyuvante Matrix-M.
Los adyuvantes se incorporan a algunas vacunas para mejorar la respuesta inmunitaria de la persona vacunada.
La proteína de pico de esta vacuna se produce en las células de insectos; el adyuvante Matrix M contiene extractos de saponina de la corteza del árbol Soapbark, que es originario de Chile.
«Tras un análisis y una evaluación exhaustiva de los datos, y la evaluación de los procesos de fabricación y la información, así como de las aportaciones del comité de asesores externos independientes de la FDA, los expertos médicos y científicos de la FDA han determinado que la vacuna cumple con los altos estándares de seguridad y eficacia de la FDA para la autorización de uso de emergencia», dijo el Dr. Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA.
«La vacuna contra el COVID-19 de Novavax con adyuvante proporciona otra alternativa para los adultos y añade otra vacuna al suministro de vacunas contra el COVID-19 para los Estados Unidos. El público estadounidense puede confiar en que esta vacuna, como todas las que se utilizan en los Estados Unidos, ha sido sometida a la rigurosa y exhaustiva revisión científica y reglamentaria de la FDA».